Современные данные о видах иммунного ответа
Зміст
Резюме. В статье раскрыто современное определение иммунного ответа. Филогенез иммунитета составляет единую систему и является неотделимой частью развития многоклеточных микроорганизмов. Возникновение многоклеточных организмов способствовало формированию обособленного сообщества клеток, которые бы отвечали за поддержание гомеостаза внутренней среды организма. Взаимодействие данных клеток явилось прообразом современного иммунитета, а видом регуляции постоянства внутренней среды стал иммунный ответ. Роль иммунного ответа в организме заключается в следующем: поиск и элиминация чужеродных частиц, как проникающих экзогенно (возбудители инфекционных заболеваний), так и эндогенно образованных (инфицированные вирусами клетки, опухолевые клетки). Определена роль врожденного и приобретенного иммунного ответа. Особый акцент сделан на патоген-распознающие рецепторы, на их различные виды. Раскрыто понятие патоген-распознающих рецепторов, показаны их взаимодействие и активация при различных видах патогенов. Охарактеризованы современные представления об интерлейкинах и факторах транскрипции.
Иммунная система всегда представляла одну из самых сложных и интригующих загадок в человеческом организме. Даже в 2020 г. ведутся споры о том, как происходит активация и распознавание антигена иммунной системой, тот ли вид рецепторов или тот ли определенный патоген запускает ее работу. С открытия данного вида регуляции организма прошло уже более ста лет, и мы до сих пор открываем для себя все новые и новые элементы ее работы. В связи с информацией, полученной в период с 2005 г. по 2019 г., роль иммунной системы в ранней фазе развития инфекции и воспаления пересматривается.
Патоген-распознающие рецепторы и молекулярные структуры, ассоциированные с гибелью клеток
Врожденный иммунитет считается «первой линией защиты» от проникновения патогена, за счет быстрого распознавания которого запускается инициация патоген-специфического адаптивного иммунного ответа. Адъюванты усиливают и запускают иммунный ответ. Действие данного класса веществ осуществляется при помощи патоген-распознающих рецепторов (Раthogen Recognizing Receptors – PRRs) иммунокомпетентных клеток, которые взаимодействуют с молекулярными структурами патогенных микроорганизмов (патоген-ассоциированные молекулярные образы – Pathogen Associated Molecular Patterns – PAMPs).
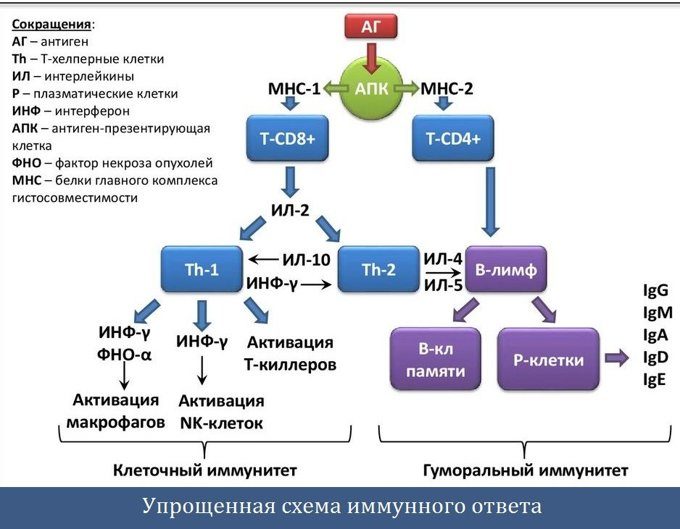
При контакте PAMPs и PRRs возникают сложные сигнальные каскады, с помощью которых возможна продукция клетками соответствующего набора хемокинов и цитокинов, включая интерфероны, увеличивающие способность антиген-презентирующих клеток представлять антиген и стимулирующие миграцию дендритных клеток в лимфоидные ткани, где происходит их встреча с Т- и В-лимфоцитами, в результате чего формируется адаптивный иммунный ответ [1].
В 1996 г. были открыты и изучены структуры системы врожденного иммунитета, такие как «патоген-ассоциированные молекулярные образы», или PAMPs. Наиболее распространенными PAMPs являются липополисахариды, которые находятся в составе клеточной стенки грамотрицательных бактерий, липотейхоевые кислоты грамположительных бактерий, ДНК бактерий, РНК вирусов.
Данные классы этих молекулярных структур PAMPs имеют общие свойства:
- PAMPs вырабатываются преимущественно микроорганизмами, в макроорганизме синтез данных веществ не происходит. Активация патоген-ассоциированного молекулярного образа любыми видами из патоген-распознающих рецепторов запускает сигнал о наличии в организме хозяина патогенного микроорганизма;
- PAMPs имеют единые структурные компоненты, присущие всем микроорганизмам.
Еще одним компонентом врожденного иммунитета, инициирующим его запуск, являются молекулярные структуры, образующиеся при гибели любых видов клеток (микро- и макроорганизмов: Damage Associated Molecular Patterns – DAMPs), которые представляют собой разнородную группу разобщенных молекул. Они содержат нуклеиновые кислоты в различных конформациях (например, одноцепочечные (ss/ds) РНК или ДНК), ядерные белки (например, группа ядерных негистоновых белков box-1, HMGB-1), цитозольные белки (например, кератин-18, K18), пуриновые нуклеотиды (например, аденозинтрифосфат, АТФ) или митохондриальные соединения (например, мтДНК, N-формильные пептиды). Определяемые эволюционными патоген-распознающими рецепторами [2] в цитозоле, DAMPs оповещают о реакции врожденного иммунитета.
Кроме того, некоторые DAMPs образуют комплексы с молекулами для усиления или облегчения передачи сигналов. Среди них — амфотерин (HMGB1), который является одним из первых идентифицированных и наиболее полно охарактеризованных DAMPs. Амфотерин — это белок, ассоциированный с хроматином, который присутствует во всех клетках животных [3]. Внеклеточный амфотерин служит промежуточным звеном в ряде биологических ответов, соединяясь с распознающими рецепторами, такими как рецептор конечных продуктов гликозилирования (RAGE), Тoll-подобный рецептор 2-го типа (TLR2), Тoll-подобный рецептор 4-го типа (TLR4), Тoll-подобный рецептор 9-го типа (TLR9), C-X-C хемокиновый рецептор типа 4 (CXCR4), рецептор Т-клеточного иммуноглобулина и домен муцина 3-го типа (Tim-3) [4, 5]. Недавние исследования показали, что восстановленный амфотерин (HMGB1) образует гетерокомплекс со стромальным производным фактором-1 (CXCL12), который способствует привлечению воспалительных клеток в поврежденную ткань путем распознавания рецептором CXCR4 [6].
Рецепторы (PRRs) являются важными компонентами врожденной иммунной системы. Они распознают микробы или повреждение тканей с помощью специфических молекулярных структур, называемых патоген-ассоциированными молекулярными образами (PAMPs) или cвязанными с опасностью молекулярными образами (DAMPs) [7, 8]. Основные функции PRRs состоят в том, чтобы стимулировать фагоцитоз и выступать посредником воспаления, обнаруживая различные патогены и молекулы из поврежденных клеток. В результате PRRs активируют воспалительные сигнальные пути, чтобы активировать врожденный иммунитет [9].
Активация находящихся на поверхности клетки и внутриклеточно расположенных рецепторов (PRRs) приводит к передаче сигналов и воспалительным реакциям. Оксидативный стресс может приводить к повреждению клеточных компонентов, таких как митохондрии, генерирующие АФК (активные формы кислорода). Увеличение выработки АФК и оксидативный стресс могут иметь множественные эффекты, включая усиление транслокации и активное высвобождение DAMPs в дальнейшем, приводя к порочному кругу [10] (рис. 1).
.jpg)
Виды рецепторов врожденного иммунитета и их классификация
Существует несколько классификаций рецепторов, самые распространенные представлены делением по функциям и типам. В зависимости от функций патоген-распознающих рецепторов они подразделяются на следующие группы: а) секретируемых внеклеточных рецепторов; б) мембранных рецепторов, участвующих в эндоцитолизе, в) сигнальных трансмембранных Toll-подобных рецепторов; г) внутриклеточных цитозольных рецепторов. Класс продуцируемых рецепторов в основном воспроизводится нейтрофилами и макрофагами/моноцитами. Рецепторы, связываясь с РАМРs инфекционного агента, предопределяют выраженность и характер процессов воспаления, а также могут воздействовать на выраженность специфического иммунного ответа [11].
На данный момент представлены несколько типов рецепторов PRRs, в том числе детально описаны сигнальные Toll-подобные рецепторы (Toll Lik-Receptors – TLRs), RIGI-подобные рецепторы (Retinoic Acid Inducible Gene Like Receptors – RLRs), NOD-подобные рецепторы (Nucleotide Binding Oligomerization Domain Like Receptors – NLRs), лектиновые рецепторы типа C (C-Type Lectin Receptors – CLRs) и цитозольные сенсоры ДНК (Cytosolic DNA Sensors – CDSs).
Самыми изученными и известными являются Toll-подоб-ные рецепторы. Большая часть этих Toll-рецепторов клетки всегда расположена ближе к поверхности, гораздо реже в цитоплазме около структуры аппарата Гольджи. На поверхностях мембран клеток располагаются данные рецепторы, начинающие взаимодействие с микроорганизмами, которые развиваются внеклеточно. Взаимодействие рецепторов происходит в парах для распознавания большинства веществ. На некоторых типах антиген-презентирующих клеток (АПК), например, на дендритных клетках (ДК), экспрессируются данные рецепторы (PRRs), что позволяет им распознавать сразу несколько антигенов патогенных микробов [12]. Данный класс рецепторов может также реагировать на разнообразные аллергены, а не только распознавать молекулярные структуры микроорганизмов. Обычно TLR, которые реагируют на бактериальные структуры, такие как триацил- и диациллипопротеины, являются трансмембранными рецепторами и экспрессируются на клеточных мембранах кишечного эпителия. TLR2 вместе со своими партнерами TLR1, TLR6 и TLR5 относятся к этой категории. Напротив, чувствительные к нуклеиновой кислоте TLR, такие как TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 и TLR13, экспрессируются исключительно на мембране внутриклеточных структур [13].
Активация TLR может проходить через MyD88 (Myeloid differentiation primary response gene – адаптерный белок, коактиватор сигнала с TLR) зависимые или TRIF (TIR domain-containing adaptor inducing interferon-beta – адаптерный белок, участвующий в индукции транскрипционного фактора IRF3) зависимые пути. Активация расположенных в эндосоме TLR (TLR7 и TLR9) через MyD88 активирует NF-κB (Nuclear factor kappa-light-chain-enhancer of activated B cells – транскрипционный фактор «каппа-би»), а также IRF7, приводя соответственно к продукции воспалительных цитокинов и IFN 1-го типа (рис. 2) [14].
.jpg)
Равнозначно с TLR другим многочисленным семейством клеточных рецепторов врожденного иммунитета являются лектины С-типа. Данный класс рецепторов распознает углеводы, которые часто связаны с посттрансляционной модификацией белков, причем это связывание требует участия ионов кальция. Но вскоре ученые пришли к выводу, что те же самые белковые модули рецепторов (CTLD) могут распознавать бактериальные, дрожжевые и даже грибковые микробные паттерны, представленные бета-глюканами и маннанами, причем это не зависит от концентраций ионов кальция. Самые изученные рецепторы этого семейства — Dectin-1, Dectin-2, DC-SIGN, Langerin, CD69, DEC-205 и маннозный рецептор CD206.
В последние годы все больше внимания уделяется изучению сигнальных путей, опосредующих запуск иммунного ответа при проникновении в клетку нуклеиновых кислот экстраклеточной локализации (вирусной РНК, вирусной и бактериальной ДНК, разных типов синтетических олигонуклеотидов, геномной ДНК) [15]. Реакция клетки на интернализацию экстраклеточных нуклеиновых кислот начинается в процессе преодоления этими PAMPs цитоплазматической мембраны. Оказавшись в цитоплазме клетки, дцДНК (двуцепочечная ДНК) или РНК молекулы опознаются соответствующими сенсорными факторами. Известны, в частности, следующие сенсоры дцДНК и активируемые ими пути трансдукции сигнала. Молекулы АТ-богатой дцДНК в цитозоле обнаруживаются РНК-полимеразой III. Полученный в результате синтеза с этой дцДНК транскрипт, содержащий 5’-трифосфат, активирует RLН-опосредованный путь индукции экспрессии генов (RLH – nucleotide binding domain and leucine rich repeat containing) IFNβ и комплекса провоспалительных цитокинов [16]. Цитозольный сенсор DAI (DNA-dependent activator of IRFs) необходим для распознавания цитозольной ДНК в В-форме определенного размера и нуклеотидного состава (интерферон-стимулирующая ДНК [ISD] или дцДНК длиной не менее 45 п.о., не содержащая CpG-мотивов) и запуска DAI-опосредованного пути активации синтеза интерферонов/цитокинов [17].
Еще одним немаловажным классом являются NOD-подобные рецепторы. Изначально роль NOD-подобных рецепторов (NLRs) в защитных реакциях на проникновение антигенов была найдена у растений, а позже и у животных. Данные рецепторы могут экспрессироваться в цитоплазме макрофагов/моноцитов, нейтрофилов, лимфоцитов, характеризуются самым высоким уровнем специфичности и участвуют в распознавании PAMPs, DAMPs.
Исходом этого контакта (PRRs с РАМРs) и активации сигнальных путей является активация большого количества генов, в частности генов провоспалительных цитокинов. Другой путь выработки некоторых цитокинов клетками — это активация иммунокомпетентных клеток факторами транскрипции, являющимися компонентами регуляторного сигнально-трансдуктивного пути.
Роль и разновидности клеточного состава иммунитета
Иммунная система располагает большим количеством клеток, которые подразделяются на субпопуляции в зависимости от их функций. Каждая субпопуляция отвечает за отдельный механизм в звене иммунного ответа. Центральная роль в клеточной фазе иммунного ответа отводится нативным CD4+ T-клеткам, отвечающим за функционирование иммунной системы, особенно за адаптивный иммунитет. Они помогают активировать другие иммунные клетки, высвобождая Т-клеточные цитокины. Клеточные элементы, входящие в состав линий защиты организма, разнообразны в зависимости от этапа, на котором происходит их активация. К клеточным элементам врожденного иммунитета относятся фагоциты (нейтрофилы, базофилы, эозинофилы, тканевые или тучные клетки), внутриэпителиальные субпопуляции лимфоцитов – Тγδ-клетки, киллеры – естественные (NK-клетки), киллерные и лимфокин-активированные киллерные клетки (ЛАК-клетки) и так называемые Pit-клетки – субпопуляция NK-клеток с фенотипом CD56+/CD16– [18]. Клетка – предшественница миелопоэза (CMP) является общей для макрофагов, гранулоцитов, тучных клеток и дендритных клеток врожденной иммунной системы. Макрофаги, гранулоциты и дендритные клетки составляют три типа фагоцитов в иммунной системе [19].
CD4+ T-клетки можно подразделить на группы, основанные на иммунологических функциях, специфических факторах транскрипции и цитокинах: Th1, Th2, Th9, Th17, Th22, T-фолликулярные и T-регуляторные клетки [20]. В ответ на провоспалительные или иные неблагоприятные условия T-регуляторные клетки трансдифференцируются в T-эффекторные клетки, включающие Th1, Th2 и Th17 типа клетки [21].
Факторы транскрипции как связь между клеточным и гуморальными звеньями иммунитета
Рассматривая систему активации иммунных клеток, мы должны упомянуть про важные элементы, с помощью которых происходит их активация. Факторы транскрипции – это группа белков, обеспечивающих прочтение и интерпретацию генетической информации. Факторы транскрипции необходимы для регуляции экспрессии генов и обнаружены у всех живых организмов [22]. T-bet (фактор транскрипции TBX21 Т-хелперов 1-го типа, кодирующийся геном T-bet) – отвечает за дифференцировку наивных Т-лимфоцитов в Т-хелперы 1-го типа. Основной транскрипционный фактор, определяющий дифференцировку в Т-хелперы 2-го типа, – GATA-3 (фактор транскрипции Т-хелперов 2-го типа, кодирующийся геном GATA3). Семейство факторов транскрипции GATA участвует также в развитии гемопоэтических клеток. Еще одним семейством факторов транскрипции является FOX – ДНК-связывающие белки, включающие в себя FOXA3, FOXC1, FOXF1, FOXP1, FOXP2, FOXP3. Подсемейство FOX представлено у млекопитающих тремя белками FOXA1, FOXA2 и FOXA3, которые известны также как HNF3 α, β, γ – ядерные факторы гепатоцитов [23]. Среди FOXP-группы транскрипционных факторов только FOXP3 обладает способностью подавлять выработку ИЛ-2, ИЛ-4 и ИФН-γ в Т-лимфоцитах.
Определенные группы клеток иммунной системы приобретают способность вырабатывать свои цитокины путем экспрессии транскрипционных факторов (табл. 1) [24, 25].
.gif)
При развитии иммунной реакции одновременно с активированными клетками образуются клетки памяти, которые не вовлекаются в данный процесс при первичном проникновении антигена и являются важной частью, на которую мы могли обратить свое внимание, но но которые занимаются воспроизведением реакции на антиген, уже побывавший когда-то в организме. В основе феномена иммунологической памяти лежит следующий факт: часть лимфоцитов антиген-специфического клона, вовлеченного в первичный иммунный ответ, «замораживается» и персистирует в организме в течение неопределенного времени [26]. Численность Т-лимфоцитов памяти на порядок выше, чем других субпопуляций лимфоцитов, обычно в 2-3 раза. Однако эффективность клеток памяти до сих пор не ясна полностью.
Хемокины и виды хемокиновых рецепторов
На момент наступления 2008 г. было известно уже около 50 молекул, составляющих хемокиновое семейство. Хемокины подразделяются на 4 класса в зависимости от расположения консервативных цистеинов в белковой молекуле: CXC, CC, CX3C и С, где С обозначает цистеиновый остаток, а Х – любой другой аминокислотный остаток, разделяющий цистеины. СХС-хемокины действуют в основном на нейтрофилы и лимфоциты, тогда как СС-хемокины – на моноциты и лимфоциты [27].
Обширный анализ популяций CD4+ Т-клеток выявил различные способности к миграции, что отражается в экспрессии уникальных наборов рецепторов хемокинов, которые опосредуют миграцию вдоль градиента хемокинов (табл. 2) [28].
.gif)
Лигандом для CCR6 является CCL20, который преимущественно продуцируется эпителиальными клетками, лимфоидными тканями, ассоциированными с органами, и печенью, что обеспечивает широкий выбор для миграции, который определяется совместной экспрессией других рецепторов хемокинов [29].
Семейство цитокинов (интерлейкины (ИЛ), хемокины, интерфероны и фактор некроза опухолей) представляет собой небольшие неструктурные белки, которые имеют множество плейотропных эффектов в различных органах [30]. Они высвобождаются в паракринных, аутокринных или эндокринных путях и могут быть вовлечены в процесс при различных инфекциях и влияют на иммунную систему как провоспалительными, так и противовоспалительными механизмами. Цитокины, которые оказывают провоспалительное действие, включают в себя интерферон-(IFN-)-γ, ИЛ-17, ИЛ-1, и фактор некроза опухоли-(ФНО-)-α, и те, которые оказывают противовоспалительное действие и включают в себя ИЛ-10, ИЛ-4 и ИЛ-1р [31]. Семейство цитокинов семейства ИЛ-12 (ИЛ-12, ИЛ-23, ИЛ-27, ИЛ-35), преимущественно вырабатываемых активированными антиген-презентирующими клетками, такими как дендритные клетки и макрофаги, выступает в ключевой иммунологической роли, способствующей координации врожденных и адаптивных иммунных реакций, главным образом посредством регуляции популяций Т-клеток [32, 33].
Тем не менее различия между про- и противовоспалительным эффектами цитокинов не всегда полностью ясны: пути взаимодействия играют важную роль как индивидуально, так и в комбинациях нескольких цитокинов, они могут способствовать усилению регуляции или подавлению других цитокинов, а определенные цитокины могут оказывать как провоспалительные, так и противовоспалительные действия [34]. Согласно цитокиновой теории заболеваний состояние здоровья характеризуется постоянной сбалансированной продукцией цитокинов на низком уровне, что необходимо для поддержания гомеостаза. Однако при сверхпродукции некоторых цитокинов могут возникать различные заболевания, тяжесть которых варьирует от легкой до смертельной [35].
В последнее десятилетие появилась новая информация о том, что приобретенный иммунитет может воздействовать на врожденный иммунитет. Как врожденный, так и приобретенный иммунитеты являются основными аналогами друг для друга и необходимы для эффективного контроля вирусных инфекций [36]. Таким образом, мы видим, что иммунная система взаимосвязана, приобретенный иммунитет дополняет функции врожденного иммунитета. Врожденный иммунитет является неотъемлемой частью филогенетического процесса. Приобретенный иммунитет характеризует весь накопленный опыт организма за всю жизнь путем приспособления к патогенам, механизмам адаптации, а также сохранения информации о патогенах. Дальнейшее раскрытие тайн механизма иммунного взаимодействия между двумя типами иммунитета поспособствует быстрой реакции на внедрение патогенного агента и скорейшей его элиминации из организма. Современный взгляд и позиция роли иммунитета в естественной и приобретенной невосприимчивости к инфекционным агентам позволят реализовать перспективы для более конкретного метода управления этим процессом при помощи вакцинации, иммуномодуляторов и других средств фармакотерапии.
Литература/References
- Huber J. P., Farrar D. J. Regulation of effector and memory T-cell functions by type I interferon // Immunology. 2011; 132: 466-474.
- Dolasia K., et al. TLRs/NLRs: Shaping the landscape of host immunity // Int. Rev. Immunol. 2018; 37: 3-19.
- Lotze M. T., Tracey K. J. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal // Nat Rev Immunol. 2005; 5: 331-342.
- Andersson U., Tracey K. J. HMGB1 is a therapeutic target for sterile inflammation and infection // Annu Rev Immunol. 2011; 29: 139-162.
- Venereau E., et al. HMGB1 as biomarker and drug target // Pharmacol Res. 2016; 111: 534-544.
- Schiraldi M., et al. HMGB1 promotes recruitment of inflammatory cells to damaged tissues by forming a complex with CXCL12 and signaling via CXCR4 // J Exp Med. 2012; 209: 551-563.
- Schaefer L. Complexity of danger: the diverse nature of damage-associated molecular patterns // J Biol Chem. 2014; 289: 35237-35245.
- Jin H. S., et al. Mitochondrial control of innate immunity and inflammation // Immune Netw. 2017; 17: 77-88.
- Santoni G., et al. Danger – and pathogen-associated molecular patterns recognition by pattern recognition receptors and ion channels of the transient receptor potential family triggers the inflammasome activation in immune cells and sensory neurons. J Neuro inflammation. 2015; 12: 21.
- Boyapati R. K., et al. Gut mucosal DAMPs in IBD: from mechanisms to therapeutic implications // Muc. Immunol. 2016; 9 (3): 567-582.
- Beutler B. Microbe sensing, positive feedback loops, and the pathogenesis of inflammatory diseases // Immunol. 2009; 227 (1): 248-263.
- Goubau D., Deddouche S., Reis e Sousa C. Cytosolic sensing of viruses // Immunity. 2013; 38: 855-869.
- Joosten L. A., et al. Toll-like receptors and chronic inflammation in rheumatic diseases: New developments // Nat. Rev. Rheumatol. 2016; 12: 344-357.
- Zakeri A, Russo M. Dual Role of Toll-like Receptors in Human and Experimental Asthma Models // Front. Immunol. 2018; 9: 1027.
- Barber G. N. Cytoplasmic DNA innate immune pathways // Immunol. 2011; 243 (1): 99-108.
- Barber G. N. Innate immune DNA sensing pathways: STING, AIMII and the regulation of interferon production and inflammatory responses // Curr. Opin. Immunol. 2011; 23 (1): 10-20.
- Xie L., et al. Molecular cloning and functional characterization of porcine DNA-dependent activator of IFN-regulatory factors (DAI) // Dev. Comp. Immunol. 2010; 34 (3): 293-299.
- Игнатов П. Е. Иммунитет и инфекция. М.: Время, 2002. 352 с. [Ignatov P. Ye. Immunitet i infektsiya. [Immunity and infection.] M.: Vremya, 2002. 352.]
- Murphy K., et al. Janeway’s Immunobiology, 9th Edition. New York, NY: Garland Science, 2016. P. 29.
- Gu J., et al. Human cd39hi regulatory T cells present stronger stability and function under inflammatory conditions // Cell Mol Immunol. 2017; 14: 521-528.
- Van Gool F. et al. A mutation in the transcription factor Foxp3 drives T helper 2 effector function in regulatory T cells // Immunity. 2019; 50: 362-377.
- Van Nimwegen E. Scaling laws in the functional content of genomes // Trends Genet journal. 2003; 19 (9): 479-484.
- Zaret K. S., Mango S. E. Pioneer transcription factors, chromatin dynamics, and cell fate control // Curr. Opin. Genet. Dev. 2016; 37: 76-81.
- Huang W., et al. ITK signalling via the Ras/IRF4 pathway regulates the development and function of Tr1 cells // Nat. Commun. 2017; 8: 15871.
- Smith E. L., et al. Splice variants of human FOXP3 are functional inhibitors of human CD4+ T-cell activation // Immunology. 2006; 119: 203-211.
- Хаитов Р. М. Иммунология. М.: ГЭОТАР-Медиа, 2018. 496 с. [Khaitov R. M. Immunologiya. [Immunology.] M.: GEOTAR-Media, 2018. P. 496.]
- Iwamoto T., et al. Molecular aspects of rheumatoid arthritis: chemokines in the joints of patients // FEBS J. 2008; 275 (18): 4448-4455.
- Trifari S., et al. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from T(H)-17, T(H)1 and T(H)2 cells // Nat Immunol. 2009; 10: 864-871.
- Lee A. Y., et al. CC chemokine ligand 20 and its cognate receptor CCR6 in mucosal T cell immunology and inflammatory bowel disease: odd couple or axis of evil? // Front Immunol. 2013; 4: 194.
- Dinarello C. Historical insights into cytokines // European Journal of Immunology. 2007; 37 (1): 34-45.
- Su D. L., et al. Roles of pro- and anti-inflammatory cytokines in the pathogenesis of SLE // Journal of Biomedicine and Biotechnology. 2012; vol. 2012.
- Eberl G. Immunity by equilibrium // Nat. Rev. Immunol. 16, 524-532.
- Hasegawa H., et al. Expanding diversity in molecular structures and functions of the IL-6/IL-12 heterodimeric cytokine family // Front. Immunol. 2016; 7: 479.
- Cavaillon J. M. Pro- versus anti-inflammatory cytokines: myth or reality // Cellular and Molecular Biology. 2001; 47 (4): 695-702.
- Tengvall S., et al. Interleukin-26: An Emerging Player in Host Defense and Inflammation // Journal of Innate Immunity. 2016; 8 (1): 15-22.
- Iwasaki A., Pillai P. S. Innate immunity to influenza virus infection // Nature Reviews Immunology. 2014; 14 (5): 315-328.
Д. А. Сизов1
Н. Ю. Рукина, кандидат медицинских наук
ФГБОУ ВО ДВГМУ, Хабаровск, Россия
1Контактная информация: king_rhobar_3@inbox.ru
Современные данные о видах иммунного ответа/ Д. А. Сизов, Н. Ю. Рукина
Для цитирования: Сизов Д. А., Рукина Н. Ю. Современные данные о видах иммунного ответа // Лечащий Врач. 2020; т. 23 (11): 35-39. DOI: 10.26295/OS.2020.98.43.008
Теги: иммунный ответ, антигены, инфекция, воспаление
- Признаки любви мужчины
- Двойственность человеческой морали с точки зрения нейронаук
- Медики назвали симптом повышенного холестерина
- Потенциальные маркеры ответа на лечение у больных хронической спонтанной крапивницей
- Определен напиток, расширяющий функциональные возможности мозга
- О воздействии курения на организм и борьбе с никотиновой зависимостью



_575x.gif)