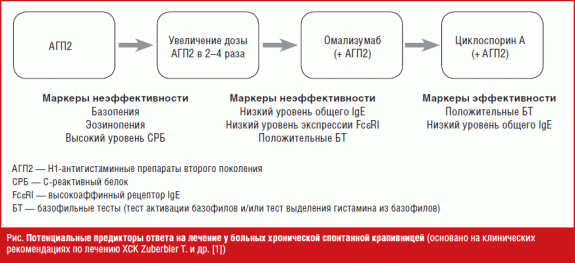
Потенциальные маркеры ответа на лечение у больных хронической спонтанной крапивницей
Зміст
Резюме. Хроническая спонтанная крапивница (ХСК) – распространенное заболевание кожи, при котором волдыри и/или ангиоотеки появляются без видимой причины и сохраняются не менее 6 недель. Рекомендуемое лечение ХСК заключается в назначении Н1-антигистаминных препаратов второго поколения (терапия первой-второй линии), омализумаба и циклоспорина. Выявление, изучение и внедрение маркеров, предсказывающих вероятность ответа пациента на терапию, позволит оптимизировать фармакотерапию заболевания путем повышения эффективности и уменьшения побочных эффектов лечения. Проведен анализ литературы баз данных MEDLINE/PubMed по ключевым словам «predictors AND treatment AND chronic urticaria», «biomarkers AND treatment AND chronic urticaria». Отобрано 25 статей. Установлено, что эозинопения, базопения и высокий уровень С-реактивного белка до лечения указывают на возможную неэффективность терапии Н1-антигистаминными препаратами второго поколения. Эозинопения, низкий уровень общего IgE в сыворотке, положительные результаты кожного теста с аутологичной сывороткой, теста активации базофилов и выделения гистамина из базофилов могут быть связаны с неэффективностью омализумаба, но эффективностью циклоспорина. Данные литературы указывают на интересные потенциальные маркеры ответа на лечение у больных ХСК. Тем не менее необходимо проведение обширных рандомизированных клинических исследований перед тем, как эти маркеры будут внедрены в рутинную клиническую практику.
Хроническая спонтанная крапивница (ХСК) — заболевание кожи, характеризующееся спонтанным появлением волдырей, зуда и/или ангиоотеков в течение 6 недель и более [1]. В большинстве случаев ХСК сохраняется 2-5 лет, хотя около 20% пациентов страдают ею более 5 лет. У пациентов с ХСК, как правило, значительно снижается качество жизни, наблюдаются нарушения сна, уменьшение производительности труда и эмоционального благополучия. В сравнительных исследованиях качество жизни пациентов с ХСК оказалось похоже или даже значительно ниже, чем при других кожных заболеваниях, например, при псориазе, атопическом дерматите, и других патологиях, например, ишемической болезни сердца [2-4].
У каждого пятого пациента заболевание устойчиво к традиционной терапии [5]. Лечение стандартными дозами антигистаминных препаратов второго поколения (АГП2) (терапия первой линии) эффективно у 39% больных, из которых только 63% отвечают на высокие дозы АГП2 (вторая линия терапии) [6]. Третья линия терапии, омализумаб, моноклональное анти-IgE-антитело, неэффективна примерно у 15% пациентов с ХСК, причем причины низкой эффективности пока исследованы мало [7]. Иммуносупрессивный препарат циклоспорин (четвертая линия терапии ХСК) оказался эффективен у 73% пациентов к 12-й неделе лечения, однако его применение ограничено из-за возможных побочных эффектов [8].
В настоящее время изучаются молекулярные и клеточные биомаркеры, позволяющие осуществлять мониторинг и прогнозирование эффективности терапии. Оценка данных предикторов ответа на лечение позволит повысить его эффективность, снизить количество нежелательных побочных эффектов, улучшить комплаентность и поможет избежать значительных расходов на терапию. В своем обзоре мы проанализировали наиболее интересные исследования возможных маркеров эффективности/неэффективности лечения ХСК (рис.).
_575x.gif)
Материалы и методы исследования
Проведен поиск релевантных публикаций в базах данных PubMed до февраля 2020 г. по словам «predictors and treatment and chronic urticaria», «biomarkers and treatment and chronic urticaria». Обнаружена 51 публикация. После анализа в связи с нерелевантностью данных исключены 42 публикации. Из дополнительных источников (списки литературы, Google Scholar и др.) отобрано 16 статей. Всего включено 25 публикаций. Критерии включения публикаций в данный обзор: наличие русскоязычных и/или англоязычных полнотекстовых рецензируемых статей с подтвержденным диагнозом «хроническая спонтанная крапивница», а также сведений об эффективности того или иного метода терапии и данных о потенциальных предикторах ответа на лечение. Критерии исключения из обзора: отсутствие полнотекстовых публикаций в базах данных, статьи в виде абстрактов, доклады с неуточненной формой крапивницы, а также публикации с нерелевантными данными.
Маркеры неэффективности терапии антигистаминными препаратами второго поколения
Эозинопения, базопения
В крупном исследовании 1613 пациентов с ХСК обнаружилось, что пациенты, не отвечающие на терапию АГП2 или омализумабом, чаще имели эозинопению (низкие значения абсолютного количества эозинофилов крови) по сравнению с больными ХСК, у которых лечение было эффективно. Более того, эозинопения оказалась ассоциирована с высокой активностью течения ХСК и аутоиммунной ХСК [9]. Показано, что сочетание эозинопении и базопении является более достоверным маркером неэффективности АГП2 [9]. В исследовании Magen и соавт. АГП2-резистентная ХСК была связана с выраженной базопенией, более высокими уровнями С-реактивного белка (СРБ), С3 и среднего объема тромбоцитов по сравнению с группой пациентов, отвечающих на терапию АГП2 [10].
Высокий уровень С-реактивного белка
СРБ — маркер специфического воспаления. В ретроспективном исследовании Kolkhir и соавт. высокий уровень СРБ до лечения указывал на низкую эффективность АГП2 в стандартных или повышенных дозах [11]. Интересно, что носители аллели rs3093059C гена С-реактивного белка с его повышенным уровнем хуже отвечали на терапию мизоластином [12].
Другие маркеры
Кожный тест с аутологичной сывороткой крови (ТАС) — внутрикожная провокационная проба, применяющаяся для диагностики аутоиммунной формы ХСК. Тест считается положительным при возникновении волдыря диаметром 1,5 мм и более по сравнению с отрицательным контролем через 30 минут после проведения теста [13]. По данным Magen и соавт. у 73,9% пациентов с АГП2-резистентной ХСК ТАС был положительным [10].
Фактор активации тромбоцитов (ФАТ) является фосфолипидным медиатором воспаления. У пациентов с ХСК наблюдалось более выраженное повышение ФАТ в сыворотке по сравнению со здоровыми добровольцами. Авторы предложили считать уровень ФАТ ≥ 5000 пг/мл возможным предиктором низкой эффективности АГП2 [14].
Маркеры неэффективности терапии омализумабом
Низкий уровень общего IgE
В нескольких исследованиях эффективность омализумаба была ниже у пациентов с исходно более низкими уровнями общего IgE по сравнению с больными, у которых IgE был выше [15-18]. Straesser и соавт., ретроспективно оценив данные 137 больных ХСК, предложили считать исходный уровень общего IgE ≤ 15,2 МЕ/мл предиктором более слабого ответа на терапию омализумабом [19].
Ertas и соавт. предположили, что у пациентов с ХСК, которые не реагируют на омализумаб, уровни общего IgE не только ниже, но и повышаются менее значимо после начала лечения по сравнению с пациентами с ХСК, которые отвечают на омализумаб [20]. Интересно, что высокий уровень общего IgE до лечения был связан с более быстрым ответом на него, а также быстрым рецидивом у пациентов после прекращения приема омализумаба [20].
Низкие уровни экспрессии FcεRI на базофилах
Deza и соавт. изучали влияние омализумаба на экспрессию высокоаффинного рецептора IgE (Fc?RI) базофилов у пациентов с активным течением ХСК и его связь с клиническим ответом. Пациенты со значительным клиническим улучшением показали выраженное снижение уровня Fc?RI на базофилах. После начала приема омализумаба экспрессия Fc?RI на базофилах снизилась на 90% через 1 месяц после введения первой дозы. Такие изменения не наблюдались у пациентов, которые не отвечали на терапию омализумабом. По мнению авторов, базовая экспрессия FcεRI является потенциальным иммунологическим предиктором ответа на терапию омализумабом (чувствительность 100% и специфичность 73,2%) [21].
Положительные результаты базофильных тестов
Тест активации базофилов (ТАБ) — метод диагностики, использующийся для выявления аутоиммунной ХСК и оценки активности ХСК. Оценку данного теста проводят с помощью проточной цитометрии, оценивая экспрессию поверхностных маркеров CD63 и/или CD203c [22]. Способность сыворотки пациентов с ХСК активировать базофилы доноров, обнаруживаемая с помощью проточной цитометрии, определяется повышенной экспрессией маркеров, что, как предполагается, отражает наличие IgG-аутоантител к IgE и/или FcεRIα у больных ХСК [23-24]. В исследовании Palacios с соавт. омализумаб был эффективнее у пациентов с ХСК, у которых отмечалось отсутствие CD203c-зависимой активации базофилов в сыворотке/низкая экспрессия CD203c на базофилах [23].
Тест выделения гистамина из базофилов (ТВГ), как и ТАБ, используется для подтверждения наличия функциональных аутоантител класса G у больных ХСК. Отрицательный ТВГ указывает на отсутствие аутоиммунной формы ХСК и ассоциирован с эффективностью лечения омализумабом. По данным Ghazanfar и соавт., предикторы лучшего ответа на терапию омализумабом — это отсутствие сопутствующего ангиоотека, отрицательный ТВГ, пожилой возраст, меньшая продолжительность симптомов и отсутствие лечения системными иммуносупрессивными препаратами в анамнезе [25]. Gericke и соавт. считают, что с большой достоверностью положительный ТВГ может прогнозировать медленный ответ (от 8 дней до 3 месяцев) на омализумаб, а отрицательный ТВГ — быстрый ответ (в течение 8 дней) [26].
Другие маркеры
D-димер, ТАС и СРБ были также предложены в качестве возможных предикторов ответа на лечение омализумабом. D-димер является продуктом распада фибрина и маркером активации процесса коагуляции/фибринолиза. В одном исследовании уровень D-димера был сравним в группах тех, кто отвечал и не отвечал на омализумаб [15]. В другом исследовании тех же авторов уровни D-димера были выше в группе больных ХСК, у которых наблюдался хороший эффект от применения омализумаба [17, 27]. Пациенты с положительным ТАС значительно медленнее отвечали на лечение омализумабом, чем ТАС-отрицательные больные [28]. По мнению Gericke и соавт. ТВГ- и ТАС-положительные респонденты, принимавшие омализумаб, соответственно в 4,5 и 5,5 раз чаще дают медленный ответ на лечение по сравнению с ТВГ- и ТАС-отрицательными пациентами [26]. Magen и соавт. установили связь ожирения, артериальной гипертензии, высокого уровня С3 в плазме крови и высоких значений СРБ с резистентностью к терапии омализумабом [7].
Маркеры эффективности терапии циклоспорином
Ретроспективный анализ 106 пациентов с ХКС, получавших циклоспорин, показал, что наличие волдырей в анамнезе, меньшая длительность болезни и положительный ТВГ могут быть предикторами эффективности циклоспорина [29]. В одном рандомизированном клиническом исследовании (РКИ) циклоспорин был эффективен у 18 из 30 пациентов. При этом 13 из 18 больных имели положительный ТВГ, тогда как в группе не ответивших на терапию положительный ТВГ был отмечен только у одного пациента [30].
Циклоспорин в дозе 3 мг/кг/день значительно эффективнее у больных с положительным ТАС по сравнению с теми, у кого ТАС отрицательный [31]. У пациентов с эффективностью циклоспорина отмечалось снижение ответа на ТАС после терапии циклоспорином [30].
В систематическом обзоре, включающем 1 РКИ и 12 нерандомизированных исследований, сообщалось о связи между снижением уровня D-димера, сывороточных ИЛ-2, ИЛ-5 и ФНО-α и клиническим улучшением на фоне терапии циклоспорином. Авторы полагают, что положительный ТАС, исходный положительный ТВГ, положительный ТАБ, повышенные исходные уровни D-димера плазмы, сывороточных ИЛ-2, ИЛ-5, ФНО-α и исходные низкие уровни общего IgE могут быть предикторами эффективности циклоспорина А [8]. Низкий уровень общего IgE также связан с вероятностью лучшего ответа на циклоспорин в исследовании Santiago с соавт. [32].
Данные о взаимосвязи ТАС и эффективности ответа на циклоспорин противоречивы. Некоторые ученые считают, что положительный ТАС можно рассматривать как предиктор ответа [31, 33]. В других же исследованиях, напротив, такая связь не была установлена [29–30].
Заключение
Отсутствие персонифицированного подхода к лечению пациентов с ХСК может привести к снижению эффективности и повышению частоты нежелательных побочных эффектов лечения, снижению качества жизни и приверженности пациентов к терапии. Кроме того, это экономически невыгодно для пациентов и органов здравоохранения. Поиск и изучение предикторов ответа на лечение ХСК остаются актуальной задачей, что требует проведения на большой когорте пациентов РКИ наиболее интересных и потенциально полезных маркеров. Таким образом, внедрение в рутинную клиническую практику маркеров ответа на лечение позволит оптимизировать тактику ведения пациентов с ХСК.
Литература/References
- Zuberbier T. et al. The EAACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria // Allergy. 2018. Vol. 73, № 7. P. 1393-1414.
- Asero R. et al. Current challenges and controversies in the management of chronic spontaneous urticaria // Expert Rev Clin Immunol. 2015. Vol. 11, № 10. P. 1073-1082.
- Silvares M., Fortes M., Miot H. CSU and Angioedema // Rev Assoc Med Bras. 2011. Vol. 57, № 577. P. 82.
- O’Donnell B. F. et al. The impact of chronic urticaria on the quality of life // Br. J. Dermatol. 1997. Vol. 136, № 2. P. 197-201.
- Kocatürk E. et al. Looking forward to new targeted treatments for chronic spontaneous urticaria // Clin Transl Allergy. 2017. Vol. 7. P. 1.
- Guillén-Aguinaga S. et al. Updosing nonsedating antihistamines in patients with chronic spontaneous urticaria: a systematic review and meta-analysis // Br. J. Dermatol. 2016. Vol. 175, № 6. P. 1153-1165.
- Magen E. et al. Factors related to omalizumab resistance in chronic spontaneous urticaria // Allergy Asthma Proc. 2019. Vol. 40, № 4. P. 273-278.
- Kulthanan K. et al. Factors Predicting the Response to Cyclosporin Treatment in Patients With Chronic Spontaneous Urticaria: A Systematic Review // Allergy Asthma Immunol Res. 2019. Vol. 11, № 5. P. 736-755.
- Kolkhir P. et al. Eosinopenia, in Chronic Spontaneous Urticaria, Is Associated with High Disease Activity, Autoimmunity, and Poor Response to Treatment // J Allergy Clin Immunol Pract. 2020. Vol. 8, № 1. P. 318-325.
- Magen E. et al. Clinical and laboratory features of antihistamine-resistant chronic idiopathic urticaria // Allergy Asthma Proc. 2011. Vol. 32, № 6. P. 460-466.
- Kolkhir P. et al. C-reactive protein is linked to disease activity, impact, and response to treatment in patients with chronic spontaneous urticaria // Allergy. 2018. Vol. 73, № 4. P. 940-948.
- Yan S. et al. C-reactive protein (CRP) rs3093059C predicts poor mizolastine response in chronic spontaneous urticaria patients with elevated serum CRP level // Exp. Dermatol. 2019. Vol. 28, № 3. P. 240-246.
- Demirkan S., Baççioglu A. Rationale for the autologous serum skin test in acute versus chronic urticaria // Postepy Dermatol Alergol. 2019. Vol. 36, № 6. P. 703-706.
- Ulambayar B. et al. Increased platelet activating factor levels in chronic spontaneous urticaria predicts refractoriness to antihistamine treatment: an observational study // Clin Transl Allergy. 2019. Vol. 9. P. 33.
- Marzano A.V. et al. Predictors of response to omalizumab and relapse in chronic spontaneous urticaria: a study of 470 patients // J Eur Acad Dermatol Venereol. 2019. Vol. 33, № 5. P. 918-924.
- Ertas R. et al. The clinical response to omalizumab in chronic spontaneous urticaria patients is linked to and predicted by IgE levels and their change // Allergy. 2018. Vol. 73, № 3. P. 705-712.
- Cugno M. et al. IgE and D-dimer baseline levels are higher in responders than nonresponders to omalizumab in chronic spontaneous urticaria // Br. J. Dermatol. 2018. Vol. 179, № 3. P. 776-777.
- Weller K. et al. Total IgE levels are linked to the response of chronic spontaneous urticaria patients to omalizumab // Allergy. 2018. Vol. 73, № 12. P. 2406-2408.
- Straesser M. D. et al. Serum IgE as an immunological marker to predict response to omalizumab treatment in symptomatic chronic urticaria // J Allergy Clin Immunol Pract. 2018. Vol. 6, № 4. P. 1386-1388.e1.
- Ertas R. et al. Increased IgE levels are linked to faster relapse in patients with omalizumab-discontinued chronic spontaneous urticaria // J. Allergy Clin. Immunol. 2017. Vol. 140, № 6. P. 1749-1751.
- Deza G. et al. Basophil FcεRI Expression in Chronic Spontaneous Urticaria: A Potential Immunological Predictor of Response to Omalizumab Therapy // Acta Derm. Venereol. 2017. Vol. 97, № 6. P. 698-704.
- MacGlashan D. Expression of CD203c and CD63 in Human Basophils: Relationship to Differential Regulation of Piecemeal and Anaphylactic Degranulation Processes // Clin Exp Allergy. 2010. Vol. 40, № 9. P. 1365-1377.
- Palacios T. et al. Lack of basophil CD203c-upregulating activity as an immunological marker to predict response to treatment with omalizumab in patients with symptomatic chronic urticaria // J Allergy Clin Immunol Pract. 2016. Vol. 4, № 3. P. 529-530.
- Curto-Barredo L. et al. Basophil Activation Test identifies the patients with Chronic Spontaneous Urticaria suffering the most active disease // Immun Inflamm Dis. 2016. Vol. 4, № 4. P. 441-445.
- Ghazanfar M. N., Sand C., Thomsen S. F. Effectiveness and safety of omalizumab in chronic spontaneous or inducible urticaria: evaluation of 154 patients // Br. J. Dermatol. 2016. Vol. 175, № 2. P. 404-406.
- Gericke J. et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria // J. Allergy Clin. Immunol. 2017. Vol. 139, № 3. P. 1059-1061.
- Asero R. et al. Elevated baseline D-dimer plasma levels are associated with a prompt response to omalizumab in patients with severe CSU // J Allergy Clin Immunol Pract. 2017. Vol. 5, № 6. P. 1740-1742.
- Nettis E. et al. Omalizumab in chronic spontaneous urticaria: Efficacy, safety, predictors of treatment outcome, and time to response // Ann. Allergy Asthma Immunol. 2018. Vol. 121, № 4. P. 474-478.
- Hollander S. M., Joo S. S., Wedner H. J. Factors that predict the success of cyclosporine treatment for chronic urticaria // Ann. Allergy Asthma Immunol. 2011. Vol. 107, № 6. P. 523-528.
- Grattan C. E. et al. Randomized double-blind study of cyclosporin in chronic «idiopathic» urticaria // Br. J. Dermatol. 2000. Vol. 143, № 2. P. 365-372.
- Endo T. et al. Identification of biomarkers for predicting the response to cyclosporine A therapy in patients with chronic spontaneous urticaria // Allergol Int. 2019. Vol. 68, № 2. P. 270-273.
- Santiago L. et al. IgE levels are negatively correlated with clinical response to ciclosporin in chronic spontaneous urticaria // Br. J. Dermatol. 2019. Vol. 180, № 1. P. 199-200.
- Di Gioacchino M. et al. Treatment of chronic idiopathic urticaria and positive autologous serum skin test with cyclosporine: clinical and immunological evaluation // Allergy Asthma Proc. 2003. Vol. 24, № 4. P. 285-290.
Н. О. Переверзина*
Е. О. Грибалева**
А. С. Алленова**, кандидат медицинских наук
Д. М. Скандер**
П. В. Колхир**, 1, доктор медицинских наук
* ФГБУ ДПО ЦГМА УДП РФ, Москва, Россия
** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
1 Контактная информация: pavel.kolkhir@yandex.ru
Потенциальные маркеры ответа на лечение у больных хронической спонтанной крапивницей/ Н. О. Переверзина, Е. О. Грибалева, А.С. Алленова, Д. М. Скандер, П. В. Колхир
Для цитирования: Переверзина Н. О., Грибалева Е. О., Алленова А. С., Скандер Д. М., Колхир П. В. Потенциальные маркеры ответа на лечение у больных хронической спонтанной крапивницей // Лечащий Врач. 2020; т. 23 (11): 27-30. DOI: 10.26295/ OS.2020.22.86.006
Теги: кожа, волдыри, ангиооотек, кожный тест
- Определен напиток, расширяющий функциональные возможности мозга
- О воздействии курения на организм и борьбе с никотиновой зависимостью
- Общение с парнем в интернете
- Ученые придумали, как сделать обычный хлеб настоящим суперпродуктом
- Популярный овощ оказался полезен при онкологии и болезнях сердца
- Первичная заболеваемость дерматозами у селькупов — одного из народов Крайнего Севера (оседлое и кочевое население)