В рибосоме найден новый сайт связывания антибиотика
Группа ученых из России, Германии и США под руководством профессоров Сколтеха Петра Сергиева. Ольги Донцовой и профессора Университета Гамбурга Дэниела Уилсона изучила механизм, по которому работает тетраценомицин X, блокирующий процесс синтеза белка у бактерий. Выяснилось, что он действует не так, как похожий на него известный антибиотик тетрациклин, что дает хорошие перспективы по преодолению устойчивости к антибиотикам у бактерий. Результаты исследования опубликованы в журнале Nature Chemical Biology.
Резистентность бактерий к антибиотикам – одна из основных проблем современной медицины и здравоохранения, усугубляющаяся из года в год. Противостояние бактерий и разработчиков антибиотиков напоминает гонку вооружений, где человек пока едва успевает за микроскопическими паразитами. Многие традиционные антибиотики уже малоэффективны против новых бактериальных штаммов, поэтому ученым приходится придумывать что-то новое. Действие антибиотиков обычно направлено на блокировку самых важных процессов жизнедеятельности бактерий: синтез нуклеиновых кислот, белков и клеточной стенки. Новые антибиотики обычно похожи на своих предшественников, поэтому рано или поздно бактерии находят оружие и против них.
Ароматические поликетиды – одна из самых известных групп антибиотиков, к которым относятся тетрациклины, открытые в середине 20 века, и, наравне с пенициллинами, широко используемые в медицине.
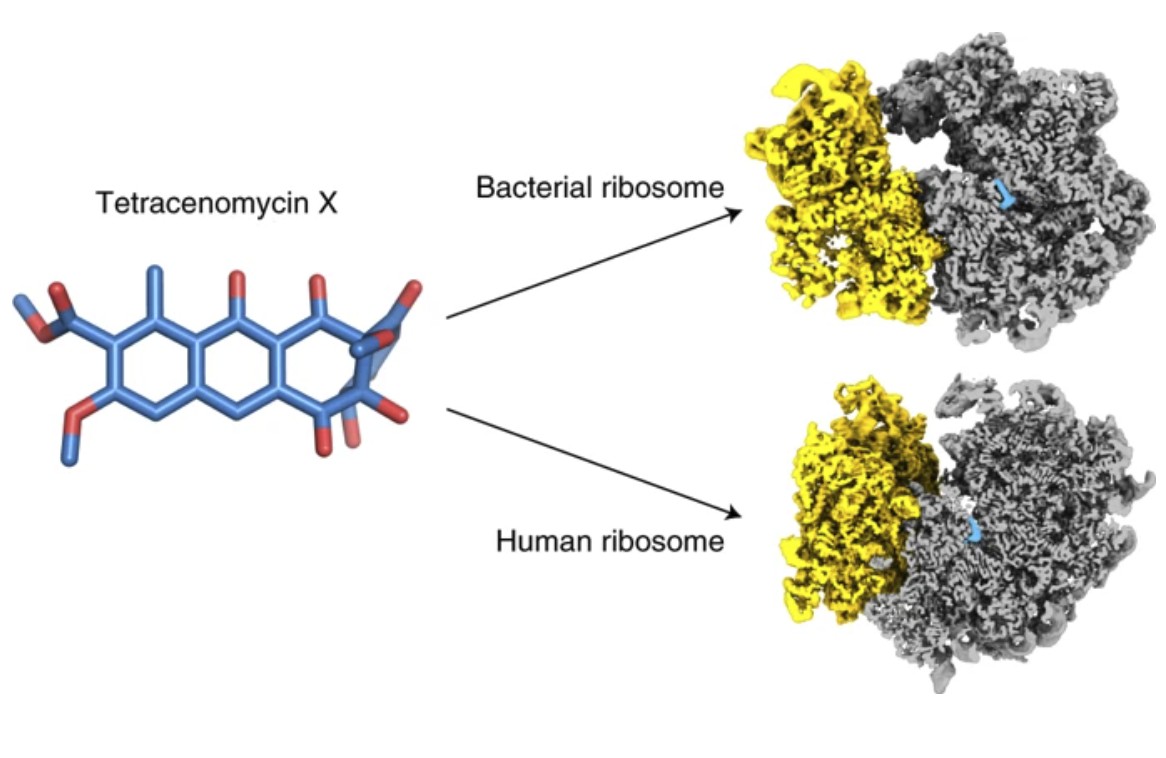
Тетраценомицины – сравнительно новая группа ароматических поликетидов. Ранее считалось, что они вклиниваются в бактериальную ДНК и вызывают нарушения при репликации (удвоении ДНК при делении клеток), однако в ходе исследования ученых из Центра наук о жизни Сколтеха совместно с коллегами из МГУ и Университета Гамбурга выяснилось, что один из представителей этого семейства – тетраценомицин X блокирует синтез белков, причем присоединяется он не к малой субъединице рибосомы, как тетрациклин, а к большой.
«При помощи криоэлектронной микроскопии удалось определить сайт связывания тетрациномицина Х с рибосомой. Он располагается в туннеле, через который синтезируемый пептид покидает рибосому, напротив сайта в котором связываются хорошо известные ингибиторы синтеза белка – макролиды и стептограмины Б» ¬– рассказывает главный научный сотрудник Сколтеха Илья Остерман.
Результаты ученых свидетельствуют, что тетраценомицин X не обладает перекрестной резистентностью с уже известными ингибиторами синтеза белка, то есть бактериальные штаммы не будут к нему заведомо устойчивы.
Обнаруженный новый структурный мотив ингибитора синтеза белка и новый сайт связывания антибиотика на рибосоме могут быть полезны для разработки новых антибактериальных препаратов.
Пресс-релиз Сколтеха.